はじめに
今回は当院健康医学センターで胃X線検査の検査精度についてお話させていただきます。先生はご存知かと思いますが、国立がん研究センターが出した「有効性評価に基づく胃がん検診ガイドライン2014年度版」の中で胃X線検査は、胃内視鏡検査と並んで、「推奨グレードB」とされており、死亡率減少効果が不利益を確実に上回る検査として、対策型検診・任意型検診としての実施を推奨されております。
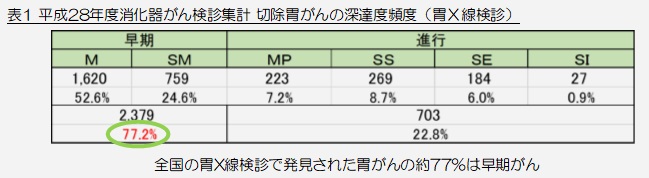
近年では日本消化器がん検診学会などにより基準撮影法が提唱され、携わる診療放射線技師を中心に普及したことにより、平成28年度の日本消化器がん検診学会全国集計によりますと、発見がんの77.2%が早期がんであるという結果がでております(表1)。
検診の最大の命題である「救命可能のがん発見」に、ある一定の効果があることが示唆されていると言っていいと思われます。
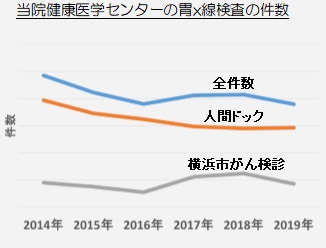
検査数は約543万件/年(全国) 当センターは2014年より減少傾向
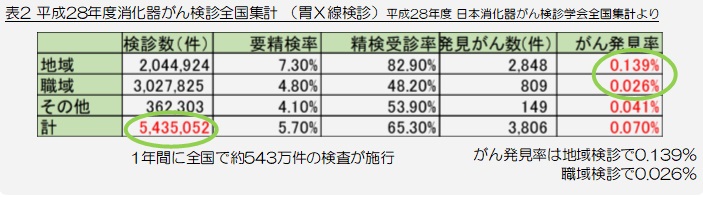
全国では1年間に約543万件の胃X線検診が行われております(表2)。
しかし当センターでの検査数は2014年より減少傾向で推移しております(右グラフ)。その大きな理由として、当センターが10年ほど前に経鼻内視鏡検査を導入したことが考えられます。
経鼻内視鏡検査は、経口法に比べて低侵襲かつ受容性が高いため、胃X線検査のかわりに選択される受診者様が増加傾向にあります。
しかしながら内視鏡検査に比べて、高スループットで技師1名にて行える低コストである胃X線検査はこれからもまだまだ検診の場では施行されていくことと思います。
当センターの検査精度
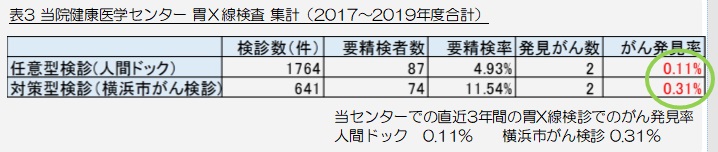
2017~2019年度の当センターの検査精度を(表3)にお示しいたします。全国集計(表2)より、①地域検診の要精検率と②がん発見率が高いのが特徴です。特にがん発見率は地域検診で約2.5倍、職域検診で約3倍の発見率となっております。有意差は検証してはおりませんが、その要因は、地域差・受診世代差・検査手技の違いなどと推定されます。
精度管理の方法、および工夫
近年のDR装置における撮影は、透視観察や撮影画像のリアルタイム観察が胃がんの拾い上げに不可欠であります。我々診療放射線技師も読影医を補助するつもりで「撮影しながら読影」して、ひとりひとりの受診者様を日々撮影しております。撮影技術の研鑽はもちろんのこと、症例検討会(最近のコロナ渦ではオンライン開催ですが)や成書で多くの胃がん症例を経験し、自施設の術前胃X線造影を通して、X線所見、内視鏡所見、そして術後病理所見を対比することによって、X線画像にfeed backし地道に一例ずつ積み上げていくのは、先人の諸先生方の手法と全くおなじであると痛感しております。また検査の特性上、受診者様に体位変換等のご協力をお願いして成立する検査であるため、最近増加傾向にあるご高齢の受診者様の安全性や利便性を向上するための工夫(緩衝用マットレス、左右表示)も行っております。
○緩衝用マットレス
逆傾斜時の撮影はマニュアルどおり安全に留意して行っておりますが、万一に備えて配置しました。

○左右表示
X線検査台にあがると、緊張から左右が一瞬わからなくなる方が多いので、さりげなくアシストする目的でつけてみました。マグネットで貼り付けるタイプのものを自作で作成しました。


私は健診を中心に業務させていただいておりますが、他にCTや血管造影、夜勤時にはMRIにも対応させていただくことがあります。検診の胃X線検査はこれらの先進的な技術を搭載した装置とは若干異なり、X線診断学や病理学的な知識・それらを具体化して根拠を示すことができる撮像技術をリアルタイムで撮影者に対して要求してきます。習得するには短期間とはいきませんが、今後とも地域のがん検診のために微力ながら研鑽していきたいと思っております。
健康医学センター担当 横山
日本消化器がん検診学会認定 胃がん検診専門技師
日本消化器がん検診学会 胃がん検診読影補助認定技師
NPO消化器がん精度管理評価機構 胃がん検診読影部門B資格
神奈川県消化器がん一次検診機関連絡協議会技術部世話人
神奈川県消化管撮影技術研究会世話人



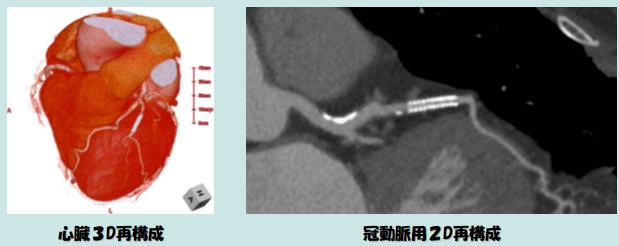
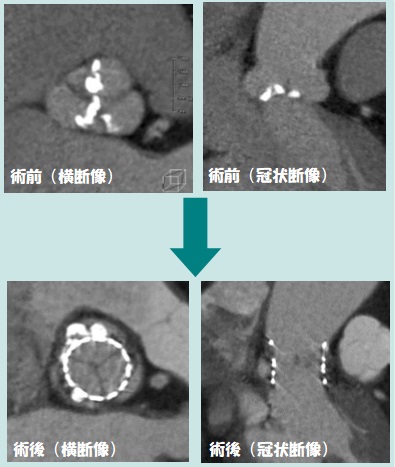
 利用例1:心臓(冠動脈)CT
利用例1:心臓(冠動脈)CT